Before Reading
Structure of Atoms – Glossary (English-Hindi) / अणु की संरचना – शब्दावली (English-Hindi)
Click For All Useful Constants
- Atom – The smallest unit of an element that retains the properties of that element.
अणु – तत्व की सबसे छोटी इकाई, जो तत्व के गुणों को बनाए रखती है। - Element – A pure substance made up of only one kind of atom.
तत्व – एक शुद्ध पदार्थ जो केवल एक प्रकार के अणुओं से बना होता है। - Subatomic Particles – Particles smaller than an atom: electrons, protons, and neutrons.
उपपरमाण्विक कण – अणु से छोटे कण जैसे इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन। - Electron (e⁻) – A negatively charged subatomic particle found outside the nucleus.
इलेक्ट्रॉन (e⁻) – ऋणात्मक आवेशित उपपरमाण्विक कण जो नाभिक के बाहर पाया जाता है। - Proton (p⁺) – A positively charged subatomic particle found in the nucleus.
प्रोटॉन (p⁺) – धनात्मक आवेशित उपपरमाण्विक कण जो नाभिक में पाया जाता है। - Neutron (n⁰) – A neutral subatomic particle found in the nucleus.
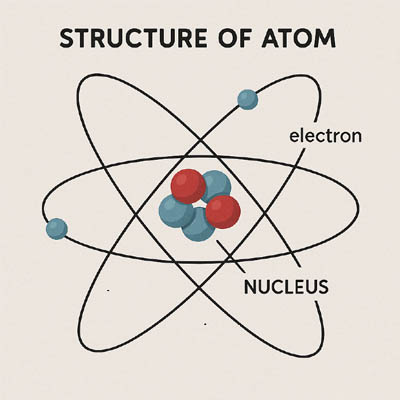
न्यूट्रॉन (n⁰) – उदासीन उपपरमाण्विक कण जो नाभिक में पाया जाता है। - Nucleus – The central part of an atom containing protons and neutrons.
नाभिक – अणु का केंद्र भाग जिसमें प्रोटॉन और न्यूट्रॉन होते हैं। - Atomic Number (Z) – Number of protons in the nucleus of an atom.
परमाणु संख्या (Z) – किसी अणु के नाभिक में उपस्थित प्रोटॉनों की संख्या। - Mass Number (A) – The total number of protons and neutrons in an atom.
द्रव्यमान संख्या (A) – किसी अणु में प्रोटॉन और न्यूट्रॉन की कुल संख्या। - Isotopes – Atoms of the same element with different numbers of neutrons.
समस्थानिक – एक ही तत्व के वे अणु जिनमें न्यूट्रॉन की संख्या अलग होती है। - Isobars – Atoms with the same mass number but different atomic numbers.
समभारिक – वे अणु जिनकी द्रव्यमान संख्या समान होती है लेकिन परमाणु संख्या भिन्न होती है। - Electron Shells/Orbits – Paths around the nucleus where electrons are found.
इलेक्ट्रॉन आवरण / कक्षा – नाभिक के चारों ओर वे पथ जहाँ इलेक्ट्रॉन स्थित होते हैं। - Valence Electrons – Electrons in the outermost shell of an atom.
संयोजक इलेक्ट्रॉन – किसी अणु के सबसे बाहरी आवरण में स्थित इलेक्ट्रॉन। - Valency – The combining capacity of an atom.
संयोजकता – किसी अणु की अन्य अणुओं से जुड़ने की क्षमता। - Octet Rule – Atoms tend to have eight electrons in their outermost shell.
ऑक्टेट नियम – अणु अपनी सबसे बाहरी कक्षा में आठ इलेक्ट्रॉन रखना पसंद करते हैं। - Duplet Rule – Hydrogen and helium aim to have two electrons in the outermost shell.
डुप्लेट नियम – हाइड्रोजन और हीलियम अपनी बाहरी कक्षा में दो इलेक्ट्रॉन रखने का प्रयास करते हैं। - Energy Levels – Fixed energies that electrons can have in an atom.
ऊर्जा स्तर – अणु में इलेक्ट्रॉनों की निश्चित ऊर्जा की अवस्थाएँ। - Bohr’s Model – A model of atom with electrons in fixed orbits around the nucleus.
बोर का मॉडल – अणु का एक मॉडल जिसमें इलेक्ट्रॉन नाभिक के चारों ओर निश्चित कक्षाओं में घूमते हैं। - Orbital – A region in an atom where there is a high probability of finding an electron.
कक्ष (ऑर्बिटल) – अणु का वह क्षेत्र जहाँ इलेक्ट्रॉन मिलने की संभावना अधिक होती है। - Electronic Configuration – Distribution of electrons in different shells or orbitals.
इलेक्ट्रॉन विन्यास – विभिन्न आवरणों या कक्षाओं में इलेक्ट्रॉनों का वितरण। - Stable Atom – An atom with a full outer electron shell.
स्थिर अणु – ऐसा अणु जिसकी बाहरी इलेक्ट्रॉन कक्षा पूर्ण हो। - Unstable Atom – An atom with an incomplete outer shell.
अस्थिर अणु – ऐसा अणु जिसकी बाहरी कक्षा अधूरी हो। - Quantum Number – A number that describes the energy levels and shape of orbitals.
क्वांटम संख्या – जो कक्षा की ऊर्जा और आकार को दर्शाती है। - Shell Notation (K, L, M, N…) – Representation of energy levels from inner to outer.
आवरण संकेतन (K, L, M, N…) – ऊर्जा स्तरों का अंदर से बाहर की ओर संकेत। - Charge – A property of particles that causes them to experience a force.
आवेश – कणों की वह विशेषता जिससे वे बल का अनुभव करते हैं।
Chapter 4 : Structure Of Atom
🔹 1. Introduction
- All matter is made up of atoms.
- The term “atom” was first used by Democritus, meaning indivisible.
- Modern atomic theory started developing after Dalton’s Atomic Theory (1808).
🔹 2. Dalton’s Atomic Theory (1808)
- All matter is made of indivisible atoms.
- Atoms of an element are identical in mass and properties.
- Atoms combine in whole numbers to form compounds.
- Atoms cannot be created or destroyed.
🟡 Limitations: Failed to explain existence of subatomic particles (electrons, protons, neutrons), and isotopes.
🔹 3. Discovery of Electrons, Protons, and Neutrons
⚛️ Electron
- Discovered by J.J. Thomson (1897).
- Found using Cathode Ray Experiment.
- Electron charge = –1.6 × 10⁻¹⁹ C
- Mass = 9.1 × 10⁻³¹ kg
⚛️ Proton
- Discovered by E. Goldstein (1886).
- Found using Canal Ray Experiment.
- Proton charge = +1.6 × 10⁻¹⁹ C
- Mass ≈ 1.67 × 10⁻²⁷ kg
⚛️ Neutron
- Discovered by James Chadwick (1932).
- Charge = 0 (neutral)
- Mass ≈ same as proton
🔹 4. Thomson’s Model of Atom (Plum Pudding Model)
- Atom is a sphere of positive charge.
- Electrons are embedded like seeds in a watermelon.
- ❌ Couldn’t explain the stability of atoms.
🔹 5. Rutherford’s Nuclear Model (Gold Foil Experiment)
- Most of the atom is empty.
- Positively charged nucleus at center.
- Electrons revolve around nucleus in circular paths.
- ❌ Couldn’t explain why electrons don’t fall into nucleus due to attraction.
🔹 6. Bohr’s Model of Atom
- Electrons revolve in fixed energy levels/shells/orbits.
- These orbits are named K, L, M, N…
- Electrons don’t radiate energy in fixed orbits.
- Energy is absorbed/released when electrons jump between orbits.
🔹 7. Atomic Number & Mass Number
🔹 Atomic Number (Z)
- Number of protons in the nucleus.
- Z = No. of Protons = No. of Electrons (in neutral atom)
🔹 Mass Number (A)
- Total number of protons + neutrons.
- A = Z + N
🔹 8. Isotopes and Isobars
🧪 Isotopes
- Same atomic number (Z), different mass number (A).
- e.g. Hydrogen: ¹H (Protium), ²H (Deuterium), ³H (Tritium)
- Applications:
- Cobalt-60 – cancer treatment
- Iodine-131 – thyroid disorders
⚖️ Isobars
- Same mass number (A), different atomic number (Z).
- e.g. ⁴⁰Ar and ⁴⁰Ca
🔹 9. Distribution of Electrons – Bohr-Bury Rules
- Max electrons in a shell = 2n² (n = shell number)
- K-shell: 2, L-shell: 8, M-shell: 18…
- Shells are filled step by step.
- Outer shell holds max 8 electrons.
🔹 10. Valency
- Valency = combining capacity of an atom.
- Depends on electrons in outermost shell.
- If outer shell < 4 → Valency = number of electrons
- If outer shell > 4 → Valency = 8 – number of electrons
- Noble gases have valency = 0
🔹 11. Electronic Configuration
- Arrangement of electrons in shells.
- Example:
- Hydrogen (Z=1): 1
- Oxygen (Z=8): 2,6
- Sodium (Z=11): 2,8,1
🔹 12. Important Terms
| Term | Definition |
|---|---|
| Atom | Smallest unit of matter |
| Electron | Negatively charged particle |
| Proton | Positively charged particle |
| Neutron | Neutral particle |
| Nucleus | Central part of atom containing protons & neutrons |
| Shell/Orbit | Path around nucleus where electrons move |
| Isotope | Same Z, different A |
| Isobar | Same A, different Z |
| Valency | Combining power of atom |

Buy Best Refference Books For Class 9th
| Subject | Buy Link |
|---|---|
| Mathematics | Click to Buy |
| Science | Click to Buy |
| English | Click to Buy |
| Social Science | Click to Buy |
| Hindi | Click to Buy |
अध्याय 4- परमाणु की संरचना
🔹 1. परिचय (Introduction)
- सभी पदार्थ परमाणुओं से मिलकर बने होते हैं।
- “परमाणु” शब्द सबसे पहले डेमोक्रिटस ने प्रयोग किया था, जिसका अर्थ है — “अविभाज्य”।
- आधुनिक परमाणु सिद्धांत की शुरुआत डल्टन के परमाणु सिद्धांत (1808) से हुई।
🔹 2. डल्टन का परमाणु सिद्धांत
- सभी पदार्थ छोटे-छोटे अविभाज्य परमाणुओं से मिलकर बने हैं।
- एक तत्व के सभी परमाणु समान होते हैं।
- परमाणु सरल अनुपात में जुड़कर यौगिक बनाते हैं।
- परमाणु को न बनाया जा सकता है और न ही नष्ट किया जा सकता है।
❌ सीमाएँ: यह सिद्धांत इलेक्ट्रॉन, प्रोटॉन, न्यूट्रॉन की खोज नहीं समझा पाया, न ही समस्थानिक (Isotopes)।
🔹 3. उपपरमाण्विक कणों की खोज
⚛️ इलेक्ट्रॉन (Electron)
- खोज: J.J. थॉमसन (1897) ने की।
- प्रयोग: कैथोड किरण नली प्रयोग
- आवेश: –1.6 × 10⁻¹⁹ कूलॉम्ब
- द्रव्यमान: 9.1 × 10⁻³¹ किग्रा
⚛️ प्रोटॉन (Proton)
- खोज: गोल्डस्टीन (1886) ने की।
- प्रयोग: कैनाल रे प्रयोग
- आवेश: +1.6 × 10⁻¹⁹ कूलॉम्ब
- द्रव्यमान: 1.67 × 10⁻²⁷ किग्रा
⚛️ न्यूट्रॉन (Neutron)
- खोज: जेम्स चैडविक (1932) ने की।
- आवेश: 0 (निष्प्रभावी)
- द्रव्यमान: प्रोटॉन के बराबर
🔹 4. थॉमसन का मॉडल (प्लम पुडिंग मॉडल)
- परमाणु एक धनावेशित गोला है, जिसमें इलेक्ट्रॉन बीज की तरह फैले हुए हैं।
- ❌ यह मॉडल परमाणु की स्थिरता नहीं समझा पाया।
🔹 5. रदरफोर्ड का मॉडल (स्वर्ण पन्नी प्रयोग)
- परमाणु का अधिकांश भाग खाली होता है।
- परमाणु का केंद्र में एक धनावेशित नाभिक (nucleus) होता है।
- इलेक्ट्रॉन नाभिक के चारों ओर परिक्रमा करते हैं।
- ❌ यह नहीं बताया कि इलेक्ट्रॉन नाभिक में गिर क्यों नहीं जाते।
🔹 6. बोहर का परमाणु मॉडल
- इलेक्ट्रॉन निश्चित कक्षाओं (shells) में घूमते हैं।
- इन कक्षाओं को K, L, M, N नाम दिया गया है।
- इलेक्ट्रॉन स्थिर कक्षा में ऊर्जा विकिरण नहीं करते।
- ऊर्जा का उत्सर्जन या अवशोषण इलेक्ट्रॉन की छलांग (jump) से होता है।
🔹 7. परमाणु संख्या और द्रव्यमान संख्या
🔹 परमाणु संख्या (Z)
- परमाणु में उपस्थित प्रोटॉनों की संख्या = Z
- न्यूट्रल परमाणु में प्रोटॉन = इलेक्ट्रॉन
🔹 द्रव्यमान संख्या (A)
- A = प्रोटॉन + न्यूट्रॉन
- A = Z + N
🔹 8. समस्थानिक (Isotopes) और समभारक (Isobars)
🧪 समस्थानिक (Isotopes)
- एक ही तत्व के परमाणु जिनकी परमाणु संख्या समान हो, पर द्रव्यमान संख्या अलग हो।
- उदाहरण: ¹H (प्रोटियम), ²H (ड्यूटेरियम), ³H (ट्रिटियम)
👉 उपयोग:
- कोबाल्ट-60 – कैंसर उपचार
- आयोडीन-131 – थायरॉइड रोग
⚖️ समभारक (Isobars)
- जिनकी द्रव्यमान संख्या समान हो, पर परमाणु संख्या अलग हो।
- उदाहरण: ⁴⁰Ar और ⁴⁰Ca
🔹 9. इलेक्ट्रॉनों का विन्यास (Bohr-Bury नियम)
- किसी कक्षा में अधिकतम इलेक्ट्रॉन = 2n² (n = कक्षा संख्या)
- K = 2, L = 8, M = 18 …
- इलेक्ट्रॉन पहले कक्षा को भरते हैं।
- बाहरी कक्षा में अधिकतम 8 इलेक्ट्रॉन हो सकते हैं।
🔹 10. संयोजकता (Valency)
- परमाणु की संयोजन करने की क्षमता।
- यह बाहरी कक्षा के इलेक्ट्रॉनों पर निर्भर करती है।
- यदि बाहरी कक्षा में 1, 2, या 3 इलेक्ट्रॉन हैं → वैलेन्सी वही है।
- यदि 5, 6, या 7 इलेक्ट्रॉन हैं → वैलेन्सी = 8 – इलेक्ट्रॉन
- पूर्ण भरी कक्षा (जैसे नियोन, हीलियम) की वैलेन्सी = 0
🔹 11. इलेक्ट्रॉनिक विन्यास (Electronic Configuration)
- परमाणु में इलेक्ट्रॉनों की व्यवस्था।
- उदाहरण:
- हाइड्रोजन (Z=1): 1
- ऑक्सीजन (Z=8): 2, 6
- सोडियम (Z=11): 2, 8, 1
🔹 12. महत्वपूर्ण परिभाषाएँ (Important Terms)
| शब्द | अर्थ |
|---|---|
| परमाणु (Atom) | पदार्थ की सबसे छोटी इकाई |
| इलेक्ट्रॉन (Electron) | ऋण आवेशित कण |
| प्रोटॉन (Proton) | धन आवेशित कण |
| न्यूट्रॉन (Neutron) | बिना आवेश वाला कण |
| नाभिक (Nucleus) | परमाणु का केंद्र जहाँ प्रोटॉन और न्यूट्रॉन होते हैं |
| कक्षा/शेल (Shell) | इलेक्ट्रॉनों की परिक्रमा पथ |
| समस्थानिक (Isotope) | एक जैसे Z, अलग A |
| समभारक (Isobar) | एक जैसे A, अलग Z |
| संयोजकता (Valency) | परमाणु की जोड़ने की शक्ति |
Useful Constants
| Name / Constant | Symbol | Value | Unit | Notes / Description |
|---|---|---|---|---|
| Electron Charge | e⁻ | −1.602 × 10⁻¹⁹ | Coulombs (C) | Negative charge particle |
| Electron Mass | me | 9.109 × 10⁻³¹ | kg | Lightest subatomic particle |
| Relative Charge of Electron | — | −1 | — | Reference unit |
| Relative Mass of Electron | — | ~1/1836 | — | Compared to proton |
| Proton Charge | p⁺ | +1.602 × 10⁻¹⁹ | Coulombs (C) | Positively charged particle |
| Proton Mass | mp | 1.673 × 10⁻²⁷ | kg | Heavier than electron |
| Relative Charge of Proton | — | +1 | — | Reference unit |
| Relative Mass of Proton | — | 1 | — | Standard reference |
| Neutron Charge | n⁰ | 0 | Coulombs (C) | Electrically neutral |
| Neutron Mass | mn | 1.675 × 10⁻²⁷ | kg | Slightly heavier than proton |
| Relative Charge of Neutron | — | 0 | — | No charge |
| Relative Mass of Neutron | — | 1 | — | Similar to proton |
| Avogadro’s Number | Nₐ | 6.022 × 10²³ | particles/mol | Number of atoms in 1 mole |
| Speed of Light in Vacuum | c | 3 × 10⁸ | m/s | Used in atomic & quantum calculations |
| Planck’s Constant | h | 6.626 × 10⁻³⁴ | Joule·second (J·s) | Quantum mechanics |
| Elementary Charge | e | 1.602 × 10⁻¹⁹ | Coulombs (C) | Charge of a single proton or electron |
| Permittivity of Free Space | ε₀ | 8.854 × 10⁻¹² | C²/N·m² | Appears in electrostatics |
| Atomic Mass Unit | u or amu | 1.66 × 10⁻²⁷ | kg | 1/12th of the mass of a C-12 atom |

Buy Best Refference Books For Class 9th
| Subject | Buy Link |
|---|---|
| Mathematics | Click to Buy |
| Science | Click to Buy |
| English | Click to Buy |
| Social Science | Click to Buy |
| Hindi | Click to Buy |















Leave a comment